Les données indiquent des tendances vers une réduction des toxicités et de meilleurs résultats pour les sujets recevant l’association ONIVYDE/5-FU et une thérapie ciblée par anti-IL-1alpha
AUSTIN, Texas, 19 juin 2024 (GLOBE NEWSWIRE) -- XBiotech (NASDAQ : XBIT) a annoncé ce jour les données issues de son étude de phase 1/2 multicentrique randomisée, en double aveugle contrôlée contre placebo portant sur le cancer du pancréas avancé. L’étude appelée 1-BETTER portait sur l’anticorps Natrunix (anti-interleukine-1alpha) administré en association avec un protocole établi de chimiothérapie (ONIVYDE (ON) + 5-Fluorouracile (5FU) + Leucovorine (LV), un schéma thérapeutique déjà largement utilisé pour traiter le cancer du pancréas, mais associé à des toxicités difficiles à gérer et à des résultats en matière de survie loin d’être idéaux. Natrunix a été évalué en tant qu’agent anticancéreux dans le cadre d’associations de chimiothérapies cytotoxiques. Dans ce contexte, la Société estime qu’il pourrait également potentiellement améliorer la tolérance associée à la chimiothérapie.
La phase 1 était une étude d’escalade de dose chez des patients atteints d’un cancer du pancréas métastatique et cherchait à déterminer si des toxicités limitant la dose (TLD) émergeaient en association avec le schéma ON+5FU+LV en deuxième ou troisième ligne. Aucune TLD n’était attendue avec Natrunix et aucune n’a été observée. Par conséquent, la dose de Natrunix utilisée dans la phase 2 était la plus élevée de celles utilisées dans la phase 1.
Au total, 65 sujets ont été randomisés dans l’étude de phase 2 selon un rapport 1:1 afin de recevoir soit Natrunix+ ON+5FU+LV (bras 1) soit le placebo +ON+5FU+LV (bras 2) ; 33 sujets étaient inclus dans le bras 1, et 32 dans le bras 2. La période de traitement de la phase 2 était de 24 semaines et les sujets ont reçu le traitement une fois toutes les deux semaines pendant 12 cycles au total.
Les sujets inclus dans l’étude présentaient un adénocarcinome du pancréas exocrine métastatique non résécable ou en récidive, et devaient avoir vu leur maladie progresser à la suite d’un traitement antérieur à base de gemcitabine ou un traitement par FOLFIRINOX et gemcitabine. Tous les patients devaient présenter au moins une lésion mesurable en fonction des critères d’évaluation de la réponse tumorale (Response Evaluation Criteria in Solid Tumor, RECIST v1.1).
Le critère d’évaluation principal de l’étude de phase 2 était l’innocuité et la tolérance de Natrunix dans le cadre d’une utilisation avec l’association ON+5FU+LV. Dans l’ensemble, moins d’événements indésirables (EI) de toute nature ont été observés au cours de la période de traitement de 24 semaines pour le bras recevant Natrunix par rapport au groupe recevant le placebo (297 contre 336). De plus, pendant cette période, un taux nettement inférieur d’événements dans des catégories spécifiques d’événements indésirables a été observé. Une réduction de 28 % du nombre de sujets présentant des événements indésirables importants (EII) a été observée dans le bras recevant Natrunix (9 contre 33) par rapport au groupe recevant le placebo (12 contre 32) au cours de la période de traitement de 24 semaines. Chez les sujets recevant le schéma Natrunix ON+5FU+LV, une réduction d’environ 33 % des hospitalisations (80 jours contre 120 jours) a également été observée au cours de la période de traitement de 24 semaines par rapport aux sujets recevant l’association placebo + ON+5FU+LV.
Les sujets recevant l’association Natrunix ont également signalé une réduction de 22 % de la fatigue (28 contre 36), une amélioration de 32 % de l’appétit (19 contre 28) et une réduction de 41 % de la douleur (17 contre 29) au dernier jour de la période de traitement de 24 semaines par rapport aux sujets recevant l’association placebo ON+5FU+LV.
La diarrhée sévère pouvant engager le pronostic vital constitue une complication importante associée au schéma ON+5FU+LV. L’incidence des diarrhées sévères au cours de l’administration du schéma thérapeutique de 24 semaines a été divisée par deux (9 % contre 19 %) pour les patients recevant l’association Natrunix + ON+5FU+LV par rapport à ceux recevant l’association placebo + ON+5FU+LV.
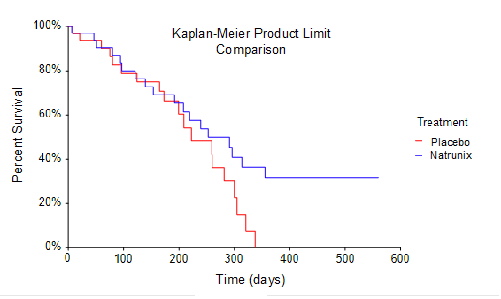
La survie globale (SG), l’un des critères d’évaluation secondaires de l’étude de phase 2, était définie de manière conventionnelle comme le temps écoulé entre la randomisation et le décès. La taille de l’échantillon de l’étude comprenait une analyse en intention de traiter de 33 sujets randomisés dans le bras Natrunix + ON+5FU+LV par rapport à 32 sujets dans le bras placebo + ON+5FU+LV. Une courbe de survie de Kaplan-Meier utilisant une méthode de comparaison produit-limite a été réalisée. Ces données mettent en évidence le constat selon lequel aucun sujet du groupe recevant l’association placebo + ON+5FU+LV (n=32) n’a survécu plus de 330 jours, tandis que 8 sujets du groupe recevant l’association Natrunix + ON+5FU+LV (n=33) étaient encore en vie au jour 330. Compte tenu de la petite taille de l’échantillon, la valeur p à la limite du significatif sur le plan statistique de p = 0,096 suggère une survie prolongée pour les sujets recevant le schéma Natrunix.
L’investigateur principal de l’étude, David J. Park, Docteur en oncologie médicale, Directeur médical du Providence St. Jude Crosson Institute à Fullerton, Californie, a déclaré : « Le traitement du cancer du pancréas avancé en deuxième et troisième ligne présente des défis importants en matière de toxicité, mais aussi d’efficacité. Il est remarquable d’observer ces tendances en matière de réduction de la toxicité et de bénéfice potentiel en matière de survie, en particulier compte tenu de la taille limitée de l’échantillon. L’interaction potentielle entre une toxicité réduite, une durée de traitement plus longue et une amélioration de la survie s’impose de manière intuitive aux cliniciens qui traitent ces patients. Ces résultats sont extrêmement importants. »
Si un nombre relativement faible de patients atteints d’un cancer du pancréas ont été inclus dans la partie de phase 2 de l’étude, la Société considère que les données suggèrent de meilleurs résultats pour le groupe recevant Natrunix + ON + 5FU + LV par rapport au bras témoin. La Société estime que la réduction du nombre d’événements graves et indésirables, la réduction significative des hospitalisations et l’amélioration de la SG au cours des périodes respectives décrites ci-dessus pour chacun de ces indicateurs suggèrent que Natrunix pourrait représenter une avancée décisive dans le traitement du cancer du pancréas.
À propos de XBiotech
XBiotech joue un rôle de pionnier dans la découverte et le développement d’anticorps ciblés, dérivés de sa technologie exclusive True Human™. La société a pour vocation de repenser la manière dont les médicaments à base d’anticorps sont découverts et commercialisés en faisant progresser son solide pipeline de véritables anticorps humains naturels dans le traitement de maladies graves comme les troubles inflammatoires, la rhumatologie, les maladies infectieuses, les maladies cardiovasculaires ou le cancer. XBiotech possède plusieurs produits candidats, dont Natrunix. Clonés à partir de donneurs individuels à l’immunité innée contre certaines maladies ciblées, les anticorps True Human de XBiotech sont conçus pour garantir une innocuité et une efficacité inégalées. Situé à quelques minutes du centre-ville d’Austin, le siège du campus de XBiotech comprend des centres de fabrication BPF, des laboratoires de recherche et d’essai, des centres de recherche sur les maladies infectieuses, ainsi que des centres d’opérations cliniques et de contrôle qualité. Pour en savoir plus, consultez le site www.xbiotech.com.
Mise en garde concernant les déclarations prospectives et les résultats de l’étude
Le présent communiqué contient des déclarations prospectives, et notamment des déclarations relatives aux convictions et aux attentes de la direction, qui induisent d’importants risques et incertitudes. Les déclarations prospectives sont assujetties à des risques et incertitudes inhérents à la prévision de résultats et conditions futurs, qui pourraient entraîner une différence considérable entre lesdites déclarations et les résultats réels. Ces risques et incertitudes sont évoqués à la rubrique « Facteurs de risque » de certains de nos documents déposés auprès de la SEC. Nos déclarations prospectives sont uniquement valables à leur date de publication. Nous n’assumons aucune obligation de mettre à jour les déclarations prospectives à la suite de nouvelles données, de futures circonstances ou d’autres facteurs postérieurs à la date de publication du présent communiqué de presse. La Société ne fait aucune déclaration concernant la SG ou tout autre indicateur au-delà des périodes spécifiquement mentionnées dans la présente. Il n’existe aucune garantie du fait que les résultats des études mentionnés dans ce communiqué de presse seront reproduits dans des études futures ou que Natrunix sera approuvé par la Food and Drug Administration ou tout autre organisme de réglementation.
Coordonnées
Wenyi Wei
wwei@xbiotech.com
Tél. 737-207-4600
Une photo accompagnant ce communiqué est disponible à l’adresse suivante : https://www.globenewswire.com/NewsRoom/AttachmentNg/7a17b3d3-b304-47ae-b1e7-0950f0301f12


